칼럼
|
<코아스템-켐온칼럼: 노화독성학> Parkinson’s disease의 기전적 3대 risk factors - (7) 관리자 2022.02.07 |
|
| 첨부파일 | |
|
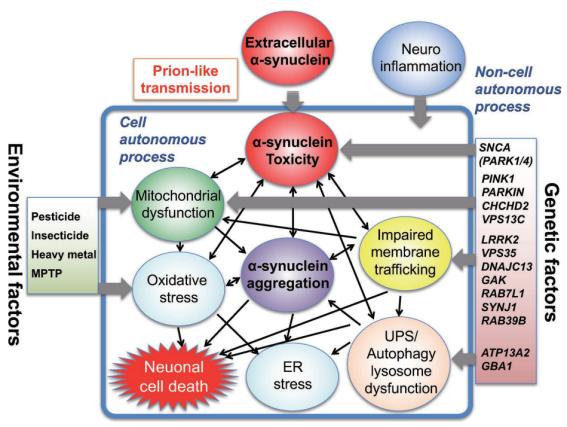
○ 파킨슨 질환(Parkinson’s disease)의 3대 risk factors로 ① 유전적 소인(Genetic predisposition),② 독성물질에 노출을 포함한 환경적 요소: , 그리고 ③ 노화(Aging) 등이 발생 기전적인 측면에서 제시되고 있다. 그러나 단순히 유전적인 소인은 극히 일부에 불과하고 대부분 후천적이면서 부분적으로 유전적 소인이 기여하는 기전으로 설명되는산발성 파킨슨 질환(sporadic parkinson’s disease)으로 이해되고 있다. ①유전적 소인(Genetic predisposition) :파킨슨 질환은 50세 이상의 사람들에게서 약 100명 당 한 사람 꼴로 발병하는데, 미국에서는 흑인보다 백인에게서 그 비율이 더 높다. 파킨슨 질환의 직접적인 원인은 특히 중뇌의 흑질과 편도체에 있는 뉴런들이 서서히 죽어가는 것이다. 우리들 대부분은 필요한 것보다 더 많은 뉴런들을 갖고 있지만 어떤 사람들은 더 적은 수의 뉴런을 가지고 시작하기도 하고 어떤 사람들은 더 빠른 비율로 상실하기도 한다. 생존하는 흑질 뉴런의 수가 정상인의 20~30% 수준으로 감소하면 파킨슨질환의 증세가 나타나기 시작한다. 세포상실이 많을수록 증세가 더 심하다.대부분의 다른 심각한 신경학적 또는 심리학적 장애들과 달리 파킨슨 질환은 유전성이 비교적 낮다.대개의 환자들에겐 파킨슨질환에 걸린 친척들이 없다. 일란성 쌍둥이 중 한 사람이 이 병에 걸린 경우, 다른 한 사람도 그럴 확률은 10%도 되지 않는다<위키피디아 자료>.이는 물론 다른 사람들이 그 병에 걸리는 확률인 0.1%보다는 분명히 높지만, 그렇게 엄청나게 높은 건 아니다. 그러나 일란성 쌍둥이 중 한 사람이 파킨슨 질환에 걸리고 다른 한 사람은 그렇지 않을 경우, 질환에 걸리지 않은 쌍둥이는 일반적으로 정상 이하 수준의 도파민 시냅스를 갖고 있다. 한 가지 가능한 해석은 어떤 유전자가 그 사람이 파킨슨 질환에 취약한 정도를 증가시키거나 감소시키며, 환경 내의 무엇인가가 그 소인이 질병으로 진행되는지 아닌지를 결정한다는 것이다. <그림-1>에서처럼현재까지 SNCA, LRRK2, VPS35, EIF4G1, DNAJC13, CHCHD2 등 10 여개 이상의 유전자가 직간접적으로 파킨슨 질환의 발생과 관련되어 있는 것으로 추정되어 있다(Hasegawa et al., 2017). 이들 유전자들은 세포 내에서 시냅스 형성, 자가소화작용(autophagy), 단백질 합성 및 수송, 그리고 미토콘드리아 기능 등에 관여하는 유전자이다.이와 같이 유전적 소인에 의한 파킨슨 질환을 가족형 PD(familial parkinson’s disease)이라고 한다.
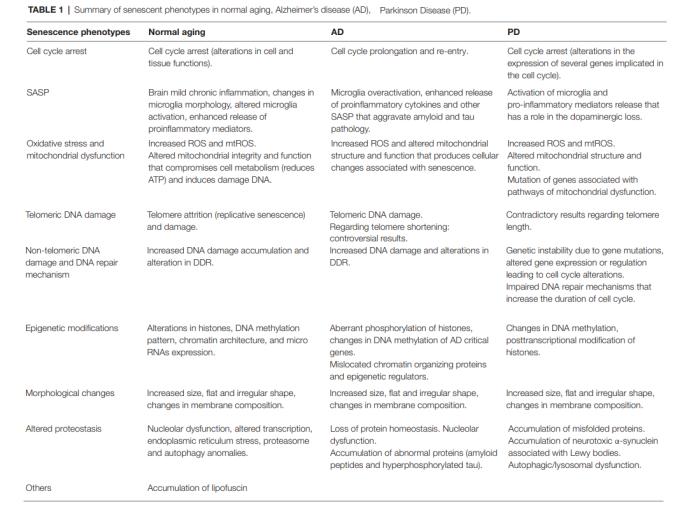
<그림-1> Schematic presentation of neuronal death in Parkinson’s disease(Hasegawa et al., 2017) ②독성물질에 노출을 포함한 환경적 요소:유전적 요인 외에 메타분석을 통해 파킨슨병의 발병에 중요한 역할을 하는 다양한 환경적 요인이 보고되었다(Noyce et al., 2012). 독성물질이 파킨슨병의 원인일 가능성은 우연히 발견되었다. 1982년 북부 캘리포니아에서 22세부터 42세의 사람들 여러 명으로부터 헤로인과 유사한 약물을 복용한 뒤 파킨슨병의 증상들이 확인되었다. 환자들이 너무 젊었기 때문에 파킨슨병이라고 진단이 쉽지 않았지만, 독성 약물이 파킨슨 질병이 원인으로 파악되었다. <그림-1>에서처럼 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine(MPTP),살충제, 중금속을 비롯하여 베타차단제(β-blocker), phenothiazines, benzamides, haloperidol, risperidone과 같은 항정신병제의 복용도 파킨슨병의 발병률을 높일 수 있다. 또한 다이옥신을 비롯하여 PCB, bisphenol A, phthalate와 같은 기존 환경호르몬과 과불화 화합물(perfluorinated compounds), 브롬화난연제(brominated flame retardants)와 같은 신종 환경호르몬도 신경계통의 독성을 통해 파킨슨 질환의 원인으로 제시되고 있다(양은영 등, 2018). 이들 독성물질 외에도 환경적 요인으로 두부 외상도 원인으로 지목되고 있다. 이와 같이 환경적 요인 단독 또는 유전적 요인 등이 복합적으로 작용하여 발생한 파킨슨 질환을 산발성 파킨슨 질환(sporadic parkinson’s disease)이라고 한다. ③ 노화(Aging):Parkinson‘s disease(파키슨병, PD) 역시 Alzheimer's disease(알츠하이머질환, AD)도 치료로 호전이 불가능한 비가역성 치매(irreversible dementia)를 유발하는 대표적인 신경퇴행성 뇌질환이다. 특히 퇴행성(degerative) 자체의 의미가 인체 노화(aging)에 의한 질환이라는 것을 뜻한다. 세포 또는 복제 세네센스(cellualr or replicative senescence) 현상도 마찬가지로 유전적 및 환경적 요인에 의해 유도되며 개체 노화의 핵심 기전으로 설명되고 있다.일반적으로 복제 세네센스는 세포분열시 발생하는 텔로미어 단축에 의해 발생하는 텔로미어 의존성 - 세네센스(telomere- dependent senescence)를 의미한다. 그러나 세네센스 현상 여러 퇴행성 질환의 원인이 된다는 것이 알려진 후에는 여러 세네센스 현상으로 구분하여 설명되고 있다. 즉, 세포의 내외적 요인에 의해 세포 자체가 가지고 있는 PD의 잠재력보다 빨리 유도되는 세네센스 현상을 “premature senescence(조기- 세네센스)"이라고 한다(Dominick et al., 2018). 유전적 및환경적인 요인에 의해 조기 세네센스가 유도가 되면 후천적 요인에 의한 복제 세네센스의 조기 유도가 AD와 PD의 발생기전이 된다고 할 수 있다. 이를 확인하기 위해서는 세포 세네센스의 바이오마크(biomarker)와 AD 및 PD에 의한 조기 세네센스 현상에 대한 비교가 필요하다.Table-2는 복제 세네센스 세포의주요 변화와 바이오마크(biomarker)에 따른 Alzheimer's disease(알츠하이머질환, AD)와 Parkinson‘s disease(파키슨병, PD)의 premature senescence 현상을 비교 한 것이다(Martinez Cue et al, 2020). 조기 세네센스을 확인하기 위한 핵심적인 변화 또는 바이오마크는 세포 복제의 비가역적 복제 중지(Cell cycle arrest),SASP(senescence-associated secretory phenotype, 세네센스-연관 분비체), 산화 스트레스와 미토콘드리아 손상(Oxidative stress and mitochondrial dysfunction), 텔로미어 DNA 손상(Telomeric DNA damage), 비텔로미어 영역 DNA 손상과 DNA 수선 기전(Non-telomeric DNA damage and DNA repair mechanism), 후생유전학적 변형(Epigenetic modifications), 형태학적 변화(Morphological changes), 그리고변형된 단백질 정체(Altered proteostasis) 등이 있다.
|
|